Dalam suatu kondisi tertentu (tekanan dan
temperatur) kebanyakan unsur dapat muncul dalam 3 wujud yaitu padat, cair, dan
gas. Wujud fisik suatu unsur sering tergantung pada situasi tertentu. Gas pada
pembahasan kali ini merupakan lebih sederhana daripada cair dan padat.
Pergerakan molekul gas tidak beraturan, gaya tarik antar molekul sangat kecil
sehingga dapat bergerak sangat bebas.
1. Keberadaan Gas
[Daftar]
Suatu gas tak mempunyai bentuk; gas mengambil bentuk dari wadahnya. Gas
tidak mempunyai volume yang tertentu, melainkan dapat dimampatkan atau
dimuaikan menurut perubahan ukuran wadah. Volume wadahnya adalah volume gas. Di
lapisan bumi yang kita tinggali, terdapat 78% N2, 21% O2,
dan 1% gas lainnya, termasuk CO2. Kali ini kita akan lebih membahas
perilaku gas dalam tekanan 1 atm dan temperatur 25℃. Dalam kondisi ini beberapa
unsur hadir dalam wujud diatomik seperti H2, N2, O2,
F2, dan Cl2.
 |
| sumber:https://it.123rf.com/photo_54533460_soluzione-%C3%A8-una-miscela-omogenea-sostanza-disciolta-in-un-altra-sostanza-solido-in-un-liquido.html |
2. Tekanan pada Gas
[Daftar]
Suatu sifat yang mengesankan dari gas adalah kedapat-mampatkannya atau
lawannya, keadapat-muaiannya. Pengukuran tekanan gas biasanya diukur melalui
manometer. Manometer adalah sebuah tabung-U yang diisi dengan suatu cairan dan
merupakan alat yang memudahkan untuk mengukur selisih tekanan yang kecil.
Manometer yang ditunjukkan pada gambar dibawah mempunyai satu kaki yang terbuka
ke udara dan mengukur selisih antara tekanan udara pada suatu sisi dan tekanan
dalam sebuah wadah tertutup pada sisi lain. Dengan suatu manometer yang berisi
merkurium, selisih permukaan dalam kaki-kaki itu dapat langsung ditambahkan
atau dikurangkan dari tekanan barometrik.
 |
| Sumber:https://courses.lumenlearning.com/openstax-chemistry/chapter/gas-pressure/ |
Sebuah manometer tidak sesuai untuk mengukur selisih tekanan yang besar. Satu
tipe alat ukur tekanan untuk mengukur tekanan tinggi mempunyai puputan
(embusan) logam yang akan memuai bial tekanan bertambah. Gerak puputan ini
diteruskan ke jarum penunjuk yang menyatakan besarnya tekanan pada suatu cakra
angka.
- Hukum Boyle
Pada abad ke-17 Robert Boyle, mempelajari perilaku gas secara sistematis
dan kuantitatif. Hukum ini berbunyi “Jika temperatur tetap konstan, volume
suatu gas dengan massa tertentu, berbanding terbalik dengan tekanan.”
- Hukum Avogadro
Hubungan ini dirumusakan oleh Amadeo Avogadro pada tahun 1811 yang lebih
dikenal sebagai hukum Avogadro. Hukum ini berbunyi “Molekul yang sama banyak
terdapat dalam gas-gas berlainan yang volumenya sama, jika tekan dan
temperaturnya sama.” Konsep ini digunakan untuk membantu menganalisis situasi
dimana volume atau tekanan atau temperatur tidak sama.
- Hubungan antara Temperatur dan Volume (Charless-Gay Lussac)
Penelitian oleh Jacques Charles dan Joseph Gay Lusac menemukan bahwa pada
tekanan yang konstan, volume gas memuai ketika dipanaskan dan menyusuk ketika
didinginkan.
- Hubungan antara Tekanan dan Temperatur (Gay Lussac-Amontons)
Gay Lussac dan Guillaume Amontons menemukan bahwa “Tekanan suatu gas pada
massa tertentu berbanding lurus dengan temperatur mutlak, bila volume tidak
berubah.”
- Hukum Charles
Jacques Charles menyatakan berdasarkan hasil penemuan dan penelitiannya “Jika
tekanan tidak berubah, volume gas dengan massa tertentu, berbanding lurus
dengan temperatur mutlak.”
4. Persamaan Gas Ideal
[Daftar]
Volume suatu gas berbanding langsung dengan banyaknya mol yang ada, n, dan
pada temperatur mutlak T, dan berbanding terbalik dengan tekanan, P.
Gabungan dalam satu pernyataan (dari) hukum Boyle, Charles, Gay Lussac-Amonton,
serta Avogadro ini disebut Hukum Gas Ideal.
5. Daftar Pustaka
[Daftar]
6. Link Download
[Klik di sini]




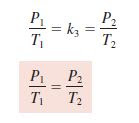



No comments:
Post a Comment